Mireu-vos aquest vídeo del canal de YouTube QuantumFracture. A mi em sembla que no té desperdici. Estàs preparat/da per aquest...salt quàntic! perquè segurament se't trencaran tots els esquemes. Després ves llegint lo que està escrit a continuació. I si necessites veure el vídeo més d' una vegada fes-ho. I si tens preguntes al respecte, fes-me-les arribar publicant-les en comentaris.
Això que escric a continuació pots considerar-ho d' ampliació...
La idea és que el model atòmic de Bohr era molt bo perquè aconseguia explicar les línies espectrals discontinues que s' obserbaven al fer passar la llum emesa per un gas monoatòmic (al ser escalfat) per un prisma.
El problema va ser que en qüestió de molt pocs anys van anar aconsenseguir millorar la precisió dels instruments òptics que utitlizaven per a veure les línies espectrals i van començar a veure'n més de les que podien ser justificades (exactament) segons el model atòmic de Bohr (que s' estudia detalladament a segon de batxillat). Aquest fet es coneix com desdoblament de les línies espectrals.
El model atòmic de Bohr, de fet, utilitzava ja el primer número quàntic: n (o número quàntic principal). Segons el valor d' aquest número, que només podia ser sencer (1, 2, 3, 4, 5, etc) se sabia el radi de l' òrbita de cada electró (era proporcional a n al quadrat) i la seua energía.
Per a explicar el desdoblament de les línies espectrals Sommerfield va imaginar que les òrbites podrien ser el·liptiques i que l' excentricitat d' aquestes el·lipses (lo més o menys rodones o aplanades que son) dependria del valor d' un segon número quàntic, l (o número quàntic secundari o orbital).
Això no és fácil de demostrar i en segon de batxillerat només s' anomena de forma molt pel damunt.
L' any 1923, el científic francés Louis De Broglie, al entendre que els electrons alhora que giren oscil·len al voltant del nucli, va anar un pas més enllà, i es va imaginar que l' òrbita dels electrons al voltant del nucli havia de ser algo així com:
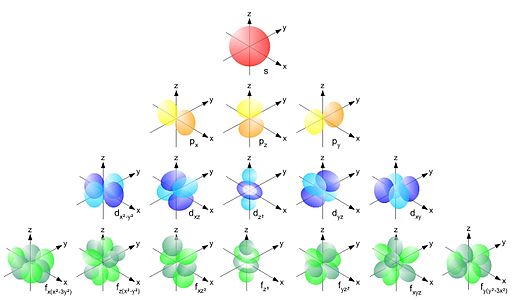
Finalment, Schrödinger va integrar en una (complicadísima) equació matemática (que és veu testimonialment en Química de 2n de bat i es demostra en Física de 2n de bat) totes les consideracions anteriors: que només certes òrbites podien ser permeses (com en el model atòmic de Bohr), que l' energía mecánica total dels electrons s' havia de conservar i que els electrons eran alhora partícules i ones. Al resoldre aquesta equació per l' àtom d' hidrogen (el més sencill possible) es van trobar amb la gran sorpresa: els electrons estaven en determinades regions de l' espai de les que només en podiem saber la probabilitat de trobar-lo i que depenien dels valors de 3 números quàntics (relacionats entre sí) dels que depenia:
- n: 0, 1, 2, 3, ..., la grandària i l' energía d' aquestes regions (orbitals).
- l = 0,..., n-1, la forma d' aquestes regions (orbitals).
- m = -l, ..., +l, l' orientació d' aquestes regions (orbitals).
Un quart número quàntic definia el sentit d' autogir de l' electró, horari o antihorari (spin), al aplicar-li un camp magnètic exterior respecte al qual s' orientaría:
- s = +1/2 o -1/2, se sol representar com una fletxa amunt o una fletxa avall.
Ara, ves al subapartat 'Modelo de Schrödinger' de l' apartat 2, 'Modelos atómicos' de la unitat 8 del llibre online (pàgines 223 i 224 del llibre en format pdf). Llix amb atenció l' explicació i estudia't la página a la que s' accedeix a partir de link vinculat al text 'Orbitales atòmicos'. I després...
TASCA: Observa la forma i la grandària dels orbitals electrònics que s' obtenen segons els valors del 4 números quàntics. Juga i observa quins valors no son possibles i pensa si entens per què...Fes click sobre A1, A2 i A3 per a entendre lo que significa el valor de cada número quàntic. Retalla i enganxa en un document tots els possibles orbitals que poden donar-se per n = 1 i per n = 2 (per simplificar-ho, només considerant s = +1/2 = +0,5). Envia'm el document per AULES abans de la data i hora indicades.
Pots contrastat les imatges que has obtingut i ampliar-es accedint al enllaç que, en el vídeo de dalt, facilita l' autor del canal de YouTube Quantum Fracture: http://www.falstad.com/qmatom/.




Soy Yago de 4a, el video me ha parecido muy interesante.
ResponderEliminar