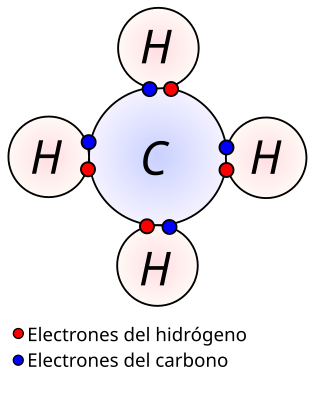
L' enllaç covalent és el que té lloc quan els elements químics lo que fan és compartir electrons per a satisfer la regla de l' octet. Això depèn del número d' electrons que tenen en l' última capa. Per exemple, el carboni en té 4 i l' hidrogen en té 1. De manera que comparting electrons tal i com es veu en la imatge superior poden formar un compost covalent, el metà, de fórmula química CH4.
Per a representar de forma molt sencilla aquest tipus d' enllaç segons el número d' electrons de la capa de valència de cada element químic se sol utilitzar un tipus de notació que es coneix com estructura de Lewis.
Ves al subapartat dedicat a l' enllaç covalent dins de l' apartat 4 dedicat a l' enllaç químic de la unitat 8 del llibre online, i aprèn a dibuixar molècules segons l' estructura de Lewis. Prem el botó amb el símbol del llapis per a accedir a l' ampliació sobre aquest punt. Després, accedeix a la part de la dreta prement sobre la il·lustració que és igual a la que hem posat en aquesta entrada i juga sel·leccionant els diversos elements químics que pots triar a veure la seua configuració electrónica i intentar adivinar la seua notació de Lewis. Avança per a veure com es representen les molècules principals amb aquesta notació.
Adona-te'n que aquest tipus d' enllaç sempre es dóna entre elements no metalls.
Ara, mira't aquest vídeo per a reforçar el concepte i també per a aprendre què és un enllaç simple, uno de doble i uno de triple, com es formen, com es representen segons l' estructura de Lewis i els casos més importants en els que això passa.
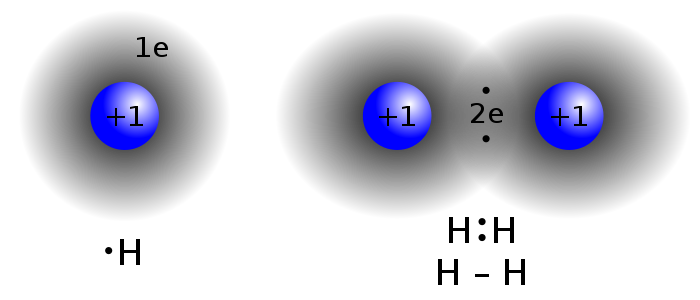
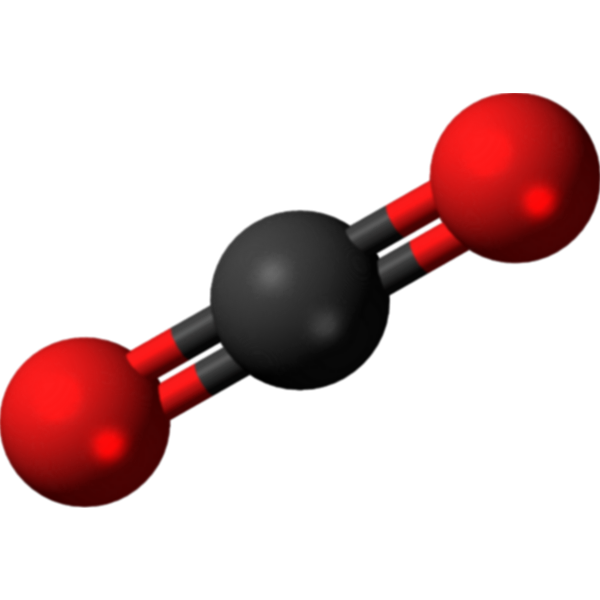
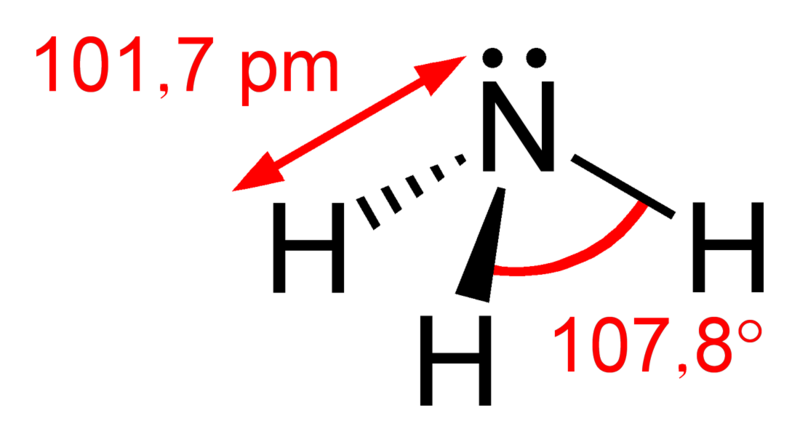
Ara, hauries de ser capaç ja d' entendre com es formen les següents molècules tant importants: hidrogen (H2), oxigen (O2), nitrogen (N2), aigua (H2O), amoníac (NH3), metà (CH4) i diòxid de carboni (CO2).
Si vols veure més exemples de molècules fes click aquí.
En la següent entrada pensarem per què el diòxid de carboni a temperatura ambient és un gas mentre que l 'aigua és un líquid. De fet, t' he deixat una pista i també pots consultar-ho en el subapartat dedicat a les forces intermoleculars dins de l' apartat 4 dedicat a l' enllaç químic de la unitat 8 del llibre online.
Si tens la resposta posa-la en un comentari i obtindràs un positiu si és satisfactòria. Ànim!








El agua es liquida a temperatura ambiente porque en su composición química tiene hidrogeno que combinados con atomos pequeños y electronegativos,como el oxigeno crea una gran fuerza intermolecular proporcionando al agua esas caracteristicas especiales
ResponderEliminarParece que digas que los átomos de oxígeno son más pequeños que los de hidrógeno. ¿Es así? ¿Qué es la electronegatividad? (Está en el libro online) ¿Por qué el dióxido de carbono es un gas a temperatura ambiente si también combina átomos de diferentes tamaños y electronegatividades?
EliminarEste comentario ha sido eliminado por el autor.
ResponderEliminar