Mira quina és la configuració electrònica del sodi (Na) i la del (Clor) i els seus possibles números d' oxidació en la pestanya d' Orbitals de la ptable. Què és lo més fácil que poden fer aquests dos elements químics per a satisfer la regla de l' octet?
Al sodi li convé cedir un electró. És un metall i com a tal té una gran tendència a cedir-lo. De totes maneres, necesita rebre algo d' energía (no hi ha res gratis) per a poder-lo cedir. Normalment, li pot arrancar un electró algún tipus de radiació (com pot ser la llum visible) que tinga la suficient energía (no ho hem estudiat encara).
Al clor li convé guanyar un electró. Si ho aconsegueix, la major estabilitat que li confereix adquirir la configuració electrónica d' un gas noble (en aquest cas, l' argó) fa que puga assolir un estat de menor energía (major estabilitat comporta menor energía), alliberant l' energía sobrant (ara ja saps que l' energía es conserva).
Al cedir un electró el sodi es converteix en un catió, ió positiu Na+. Al guanyar un electró el clor, es converteix en un anió, ió negatiu Cl-. Les càrregues de signe contrari s' atrauen i això és el que passa entre cations i anions. Però vigila. Això no passarà només entre un àtom de clor i un de sodi, sino entre una enorme quantitat d' àtoms d' aquests dos elements. De manera que al atraure's els de càrrega contraria buscaran envoltar-se d' ells, formant una estructura cristalina, la geometría de la qual dependrà dels radis respectius dels dos ions (ja ho sé, això ha sonat una mica tècnic). En l' exemple mencionat es formarà NaCl, clorur de sodi.
En l' imatge (en 3 dimensions) de l' esquerra els ions de sodi s' han pintat (simbòlicament) de color violeta i els de clor de color verd. L' imatge de la dreta (en 2 dimensions) mostra els símbols dels ions respectius.
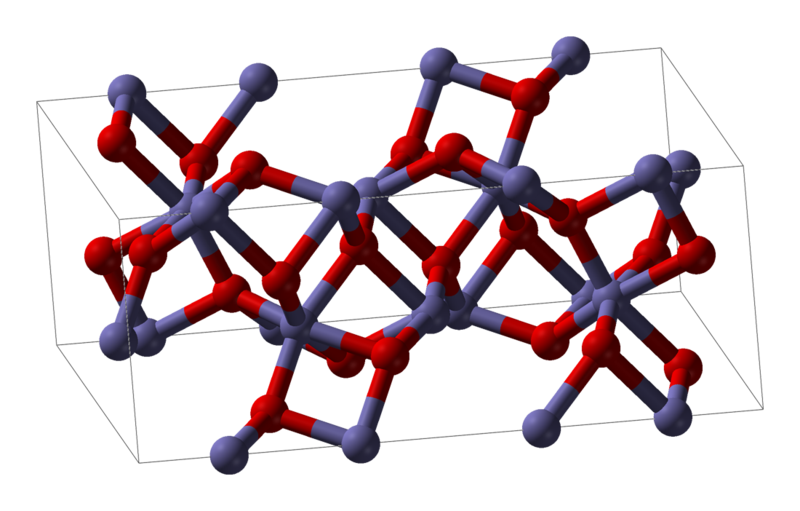
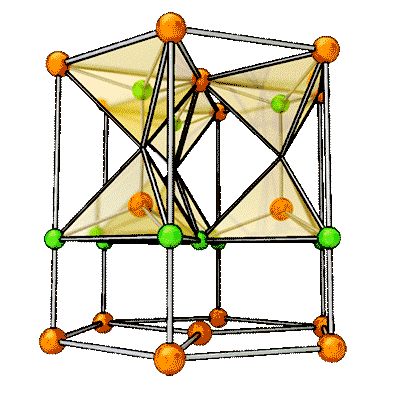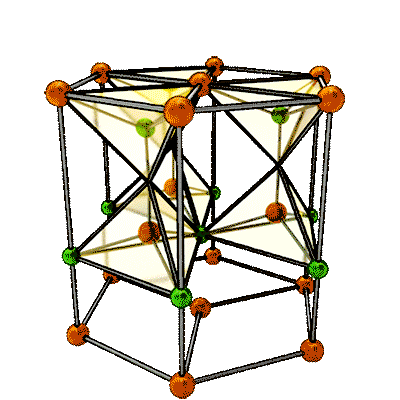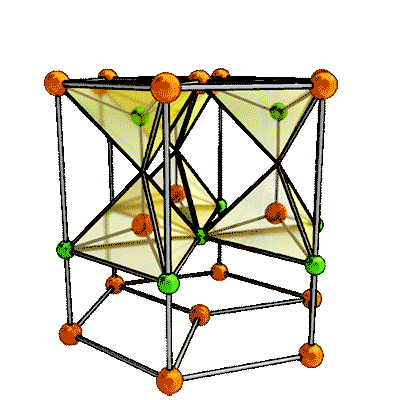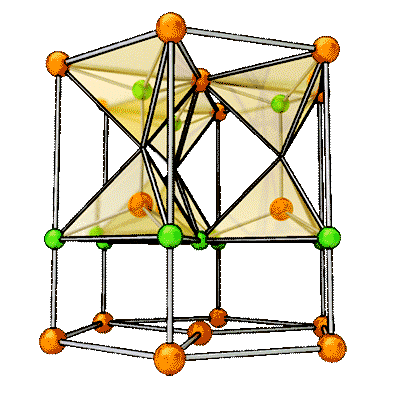
Veiem com resulta l' estructura cristalina de l' òxid fèrric, del qual haviem mostrat el procés esquemàtic de transferència d' electrons en l' entrada dedicada als números d' oxidació.
En ocasions, no és fácil imaginar-se com és l' estructura interna d' un cristall iònic. Hi ha diverses topologies (cúbica, hexagonal, ...) i tota una branca de la física-química (la cristalografía) dedicada al seu estudi. Aquí no pretenem que hages d' aprendre aquests detalls; només que sigues conscient de com es forma l' enllaç iònic i que dóna lloc a estructura cristalines.
Revisa ara el subapartat dedicat a l' enllaç iònic en l' apartat dedicat a l' enllaç químic en la unitat 8 del llibre online. Avança en les diverses opcions de la part animada de la dreta de la página i intenta constestar els exercicis interactius per a consolidar un autoaprenentatge.
De totes manera, aquesta entrada no té una tasca associada que hages d' entregar.
De totes manera, aquesta entrada no té una tasca associada que hages d' entregar.




No hay comentarios:
Publicar un comentario