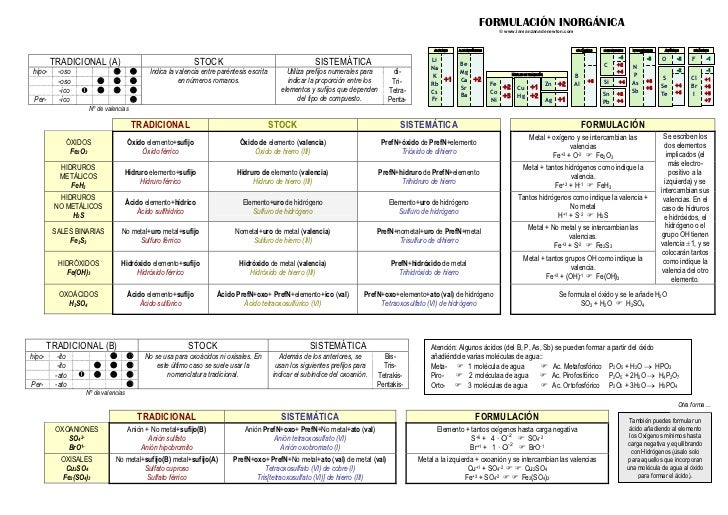
Els orbitals electrònics son la conseqüència immediata del
model mecanoquàntic, el qual és tan complex matemàticament parlant que fins a 2n de batxillerat no podem justificar-lo una miqueta. El que sí podem fer és intentar veure com interpretar-los.
Tècnicament parlant "els orbitals atòmics son la regió de l' espai en la que hi ha una determinada probabilitat (posem el 90 %) de trovar l' electró).
Cada orbital atòmic té una grandària, una energia, una forma i una orientació. I tot això depèn del valor que prenent una números quàntics que només poden prendre valors sencers, coneguts com:
n: número quàntic principal, pot valer 1, 2, 3, 4, ... Del seu valor depèn el radi de l' orbital (aquest és proporcional a n al quadrat, tal com es pot demostrar en 2n bx) i també la seua energia (la qual és inversament proporcional a n al quadrat i és negativa).
l: número quàntic secundari o azimutal, només pot prendre valors sencers entre 0 i n-1 i del qual depèn la forma de l' orbtital.
m: número quàntic magnètic, només pot prendre valores sencers entre -l i +l i del qual depèn l' orientació de l' orbital Per tant:
si n = 1: l' única possibilitat és
si n = 2: hi ha dos possibilitats:
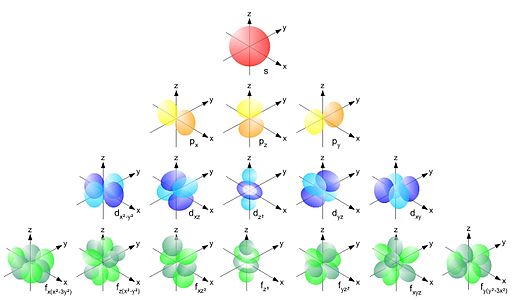
l = 0 (orbital s, però unes 4 vegades més gran que el correponent a n = 1)
l = 1 (orbital amb dos lòbuls frontals, com el símbols de l' infinit però en 3 dimensions, que rep el nom de p) i el qual pot orientar-se de 3 formes diferents segons:
m = -1 (el seu eix coincideix amb l' eix x; de fet, se'l pot anomenar px o p-1)
m = 0 (el seu eix coincideix amb l' eix y; de fet, se'l pot anomenar py o p0)
m = +1 (el seu eix coincideix amb l' eix x; de fet, se'l pot anomenar pz o p+1)
si n = 3: hi ha tres possibilitats:
l = 0 (orbital s, però unes 9 vegades més gran que el corresponent a n = 1)
l = 1 (3 possibles orbitals p, segons les 3 posisbles orientacions perpendiculars entre sí descrites per l = 1, només que més grans (en realitat 9/4 vegades més grans, potser ho estaves ja intuïnt...)
l = 2 (5 possibles orbitals de formes més extranyes però molt belles, els quals s' anomenen d)
Etc (per n = 4 i l = 3 als 7 posibles orbitals se'ls anomena f).
Els noms dels orbitals (s, p, d, f) responen a motius històrics en el quals no entrarem. Per a referir-nos a un orbital concret li posarem davant el valor de n al qual està associat. Parlarem, per exemple, d' orbitals 1s, 2s, 2s, 3s, 3p, 3d, 4s, 4d,...
Cada uns d' aquests orbitals té una energia associada. No és obvi trobar com ordenar aquests orbital de menor a major energia, però aprendrem una regla per a fer-ho. De moment, pots anar al subapartat 'Nivells d' energia i orbitals' de l' apartat 2 de la
unitat 8 del llibre online (Models atòmics) i comprovar si ets capaç d' entendre el que representa la il·lustració de la dreta i per què cada nivell d' energia associat al número quàntic n (distingible per diferents colors) es desdobla en subnivells i com aquests s' ordenen.
Ara pensa, en cada suborbital (és a dir, el que identifiquen pel valor concret de 3 números quàntics, n, l i m; és a dir, associat a cada una de les línies del diagrama de la página del llibre a la que ens hem referit en el pàrraf anterior, en la part de més a la dreta) només pot haver 2 electrons amb spins contraris (recorda l' spin respon al quart número quàntic s i només pot valor +1/2 o -1/2). Normalment es representa l' spin s = +1/2 com una fletxa amunt i s = -1/2 com una fletxa avall. Aquesta restricció es conneix com Principi d' exclusió de Pauli.
Tenint això últim en compte, pensa en lo següent...
Quants electrons, com a màxim, podran cabre entre tots els orbitals associats a n = 1?
Quants electrons, com a màxim, podran cabre entre tots els orbitals associats a n = 2?
Quants electrons, com a màxim, podran cabre entre tots els orbitals associats a n = 3?
Quina relació tenen els valors associats amb les respostes anteriors amb la taula periòdica?
Contesta'm amb un comentari.
Ara, ves a la pestanya d' Orbitals de la
ptable.com. Observa com es distribueixen els electrons per orbitals per ordre creixent l' energia col·locant el cursos sobre qualsevol dels elements de les 4 primeres files i com s' escriu la configuración electrónica dels mateixos. Per últim, revisa el subapartat 'Configuració electrònica' de l' apartat 2 de la
unitat 8 del llibre online.